Behandlungen: Hämatologie / Onkologie
In unserer Abteilung für Hämatologie und Onkologie bieten wir unseren Patientinnen und Patienten die kompetente und umfangreiche stationäre wie ambulante Diagnostik und Behandlung hämatologischer und onkologischer Erkrankungen.
Onkologische Ambulanz und Tagesklinik
Durch die ständige Weiterentwicklung der Krebsmedikamente (Chemotherapie, antihormonelle Substanzen, Immuntherapie z.B. mit Antikörpern und spezifische Target-Therapien) sind diese Behandlungen in den vergangenen Jahren zunehmend verträglicher geworden. Mit der ambulanten Therapie wollen wir dem Wunsch nach mehr Lebensqualität nachkommen.
Die Schwerpunktpraxis für Hämatologie und Onkologie wurde 1984 an der Klinik Dr. Hancken etabliert und wird heute geleitet von Dr. Sabine Matutat und Dr. Wiebke Timm. Durch die enge Zusammenarbeit mit der radiologisch-nuklearmedizinischen und der strahlentherapeutischen Abteilung am gleichen Standort wird der onkologische Schwerpunkt um ein großes Spektrum diagnostischer Möglichkeiten wie Sonographie, Computertomographie, Kernspintomographie (MRT), PET-CT und Szintigraphie ergänzt. Aber auch spezielle therapeutische Verfahren wie punktgenaue Strahlentherapie und interventionelle lokalisierte Tumortherapien werden angeboten. Gemeinsam mit der Klinik Dr. Hancken, dem Elbeklinikum Stade sowie den Hausärzten und Fachärzten der Elbe-Weser-Region sind die Patienten in einem Netzwerk vertrauensvoller und zuverlässiger ärztlicher Kooperation optimal medizinisch betreut.
Seit über 30 Jahren besteht eine enge Kooperation mit dem Elbeklinikum Stade und Buxtehude. Als Gründungsmitglied der Tumorzentren ist die Onkologie/Hämatologie der Klinik Dr. Hancken seit 2007 zertifizierter Kooperationspartner des Brustzentrums Stade-Buxtehude, des Darm- sowie des Pankreaszentrums Elbe-Weser, des Hautkrebszentrums Buxtehude und des Prostatazentrums Stade. Eine enge Kooperation und gemeinsame Tumorkonferenzen bestehen weiterhin mit der HNO-Klinik, mit der Thoraxchirurgie, der Frauenklinik für die gynäkologischen Tumore und mit der Radio-Onkologie. Die Patientinnen und Patienten werden für die ambulante oder stationäre onkologische Systemtherapie oder die Palliativbehandlung aus den jeweiligen Organtumorzentren der Klinik Dr. Hancken zugewiesen. Die Klinik betreibt eine Studienzentrale und nimmt an klinischen Studienprotokollen nationaler Krebsfachgesellschaften teil. Dadurch können auch neueste Therapien und Behandlungsverfahren unseren Patientinnen und Patienten zur Verfügung gestellt werden.
Öffnungszeiten des Zentrums für Hämatologie und Onkologie sowie der Tagesklinik:
Montag bis Donnerstag: 8.00 bis 16.30 Uhr
Freitag: 8.00 bis 14.00 Uhr

Team der Onkologischen Ambulanz
Onkologische Station und Palliativstation
Sollte aufgrund von komplexen onkologischen Therapien oder bei Vorliegen von Begleiterkrankungen eine stationäre onkologische oder palliativmedizinische Behandlung erforderlich sein, so können die Patientinnen und Patienten jederzeit in der Klinik Dr. Hancken aufgenommen werden. Die Klinik hat den onkologischen Versorgungsauftrag für den Landkreis Stade und steht allen Patientinnen und Patienten offen. Dort sind Prof. Dr. Frühauf, sowie das ärztliche und multidisziplinäre Team ihre Ansprechpartner. Dort betreuen sie die gleichen Ärzte, die auch in der ambulanten Behandlung für sie verantwortlich sind.
Spezialisierte ambulante Palliativversorgung (SAPV)
Das multiprofessionelle, spezialisierte Team aus Palliativmedizinern und palliativen Pflegefachkräften für den Landkreis Stade wird von der Klinik Dr. Hancken aus geleitet und die Betreuung der Patienten organisiert. In regelmäßigen, wöchentlichen Fallbesprechungen mit den betreuenden palliativmedizinisch tätigen Hausärzten und Pflegediensten, sowie den Onkologen der Klinik Dr. Hancken wird für jeden Patienten ein geeignetes Konzept erarbeitet.
Diese Behandlung können Sie in folgenden
Standorten erhalten:
Weiterführende Informationen:
Leistungsspektrum
-
- Diagnostik und Therapie solider und/oder metastasierter Tumoren, maligner Lymphome und Leukämien.
- Chemo-, Hormon- und Immuntherapien.
- Kombinierte Radio-Chemotherapien.
- Langzeittherapie mittels tragbarer Pumpen und venöser PORT-Systeme
- Behandlung mit tumorspezifischen Antikörpern, Tyrosinkinasehemmern, Neoangiogenese-Hemmern und „Biomolekülen“.
- Therapie mit Immun-Checkpoint-Inhibitoren
- Behandlung mit Bisphosphonaten und anti-RANKL-Antikörper (Denosumab)
Spezielle Therapieverfahren z.B.:
-
- Selektive interne Radio-Therapie (SIRT)
- Transarterielle Chemoembolisation (TACE)
- Radiofrequenz induzierte Thermo-Ablation (RITA)
in Kooperation mit der Nuklearmedizin bzw. der Interventionellen Radiologie. - Transfusion von Blut und Blutbestandteilen.
- Schmerztherapie und Palliativbehandlung.
- Ärztliche Leitung und Koordination des Palliativteams Niederelbe
- Ernährungsberatung und -Therapie.
- Reha- und Sozialberatung.
- Interdisziplinäre Tumorkonferenz.
Mitwirkung an nationalen und internationalen Therapiestudien.
Bei uns können Sie im Rahmen folgender nationaler und internationaler Multicenter-Studien betreut werden:
- Studien der Deutschen Hodgkin-Studiengruppe (DHSG)
- Studien der Deutschen CLL-Studiengruppe
- Studien der Deutschen Studiengruppe Niedrigmaligne Lymphome (GLSG)
- Studien der Deutschen Studiengruppe Hochmaligne Lymphome (DSHNHL)
- Studien der Deutschen Studiengruppe Multiples Myelom (DSMM)
- Studien der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO): z.B. SUCCESS
- GBG-Studien German Breast Group: ALTTO, GEPARQUINTO, GAIN, TBP, ICE, PENELOPE, OlympiA u.a.
- Studien der Arbeitsgemeinschaft Internistische Onkologie (AIO) (z.B.: Rektum-Studie, COFIT-Studie, KRK 0207, KRK 0212, KRK 0110)
- Brustkrebs: RIBBIT-Studie, IngeB-Studie, MANTA-Studie
Dies geschieht nach den international anerkannten ethischen und wissenschaftlichen Regeln für die Durchführung von klinischen Studien (Good Clinical Practice = GCP)
Was ist Krebs?
Was ist eine Krebserkrankung?
Man spricht von Krebs oder einem bösartigen Tumor, wenn sich Körperzellen auf Grund kleinster Veränderungen ihres Bauplans ungehindert vermehren. Sie verändern ihr Aussehen, bilden Knoten oder Geschwülste und wachsen in andere Organe hinein. Sie können Tochtergeschwülste (Metastasen) in benachbarten oder fernen Regionen des übrigen Körpers bilden. Auch die Blut- und Lymphzellen, die sich im Körper mehr oder weniger frei bewegen, können sich unkontrolliert vermehren und ebenfalls Knoten bilden, z.B. in der Milz, in den Lymphknoten, in der Haut, im Darm. Man spricht in diesem Fall von malignen Systemerkrankungen.
Umfangreiche und vertrauenswürdige Informationen zu Krebs gibt es beim Krebsinformationsdienst des dkfz (Deutsches Krebsforschungszentrum).
Diagnostik in der Hämatologie und Onkologie
Ein besonderer Schwerpunkt der hämatologischen Diagnostik ist die Untersuchung von Blut- und Gewebeproben. Aus der Analyse von Blutbestandteilen und aus der Charakterisierung von Gewebezellen lassen sich bedeutsame Erkenntnisse zur Beurteilung einer bösartigen Erkrankung ermitteln. Dies ist die Voraussetzung für die Planung und Durchführung spezieller Krebstherapien.
Differenzierung des Blutbildes
Eine der wichtigsten und einfachsten Untersuchungen der Hämatologie ist die Differenzierung des Blutbildes.
Wie geht das ?
Hierzu ist eine normale Blutabnahme notwendig, die Differenzierung erfolgt am Mikroskop. Im Blut kann man gegebenenfalls krankhafte Zellen erkennen, die für die Erstellung der Diagnose wichtig sind.
Knochenmarkpunktion
Um eine Aussage über Störungen oder krankhafte Veränderungen der Blutbildung zu erhalten, wird in bestimmten Fällen eine Knochenmarkpunktion durchgeführt. Das Knochenmark liegt im Inneren des Knochens und ist der Ort der Blutbildung. Diese ist nicht zu verwechseln mit dem Rückenmark, das im Zentrum der Wirbelsäule verläuft und aus Nervensträngen besteht, die das Gehirn mit den Nervenleitungen des Körpers verbindet. Eine Knochenmarkpunktion ist also keine Rückenmarkpunktion!
Wie geht das ?
Für die Punktion des Knochenmarkes liegt der Patient auf der Seite und zieht die Beine zum Körper an. Es wird dann zunächst eine Desinfektion der Haut im Bereich des Beckenknochens durchgeführt. Die Haut und das Gewebe werden dann örtlich betäubt. Danach wird die eigentliche Punktion mit einer Biopsienadel durchgeführt. Es wird sowohl Knochenmark als auch in den meisten Fällen ein kleiner Knochenzylinder gewonnen. Die Wunde wird mit einem Pflaster verklebt, welches am nächsten Tag abgezogen werden kann.
Ist es schmerzhaft ?
Die Betäubung der Haut macht ein kurz anhaltendes Brennen. Die Aspiration von Knochenmark ist kurz schmerzhaft. Das Gewinnen des kleinen Knochenzylinders tut nicht mehr weh.
Das Material wird sofort bei uns unter dem Mikroskop untersucht. Für weitergehende histopathologische, immunologische und molekulargenetische Spezialuntersuchungen wird ein Teil des Materials zusätzlich an spezialisierte Institute (z.B. an das Institut für Hämatopathologie Hamburg) geschickt.
Gewebszelluntersuchungen aus anderen Körperregionen
Mit feinen Nadeln können Gewebezellen aus nahezu allen Bereichen des Körpers meist ganz schmerzfrei gewonnen werden. Die mikroskopische Untersuchung dieser Zellen ggf. mit immunologischen und molekulargenetischen Zusatzuntersuchungen lässt in der Regel bereits eine sehr exakte Diagnose zu.
Staging-Diagnostik
Unter Staging-Diagnostik versteht man umfangreiche Untersuchungen zur Stadieneinteilung einer Tumorerkrankung oder Leukämie. Dazu gehören die körperliche Untersuchung durch den Arzt, Laboruntersuchungen und die moderne bildgebende Diagnostik (z.B. digitales Röntgen, Mammographie, Sonographie, Computertomographie, Kernspintomographie, PET-CT, nuklearmedizinische Untersuchungen etc.). Die bildgebende Diagnostik wird im Hause von den kooperierenden radiologischen Fachärzten durchgeführt.
Zur Staging-Diagnostik können ggf. auch andere Untersuchungen wie Endoskopie, Endosonographie, Laparoskopie usw. gehören. Diese Untersuchungen erfolgen in enger Kooperation bei den in Stade und Umgebung ansässigen Gastroenterologen, Pulmonologen, Chirurgen, Gynäkologen, Urologen, HNO-Ärzten und ggf. weiteren Fachdisziplinen.
Systemische Tumorbehandlungen
Krebserkrankungen werden nach dem Organ unterschieden, aus dem heraus sie entstanden sind. Je nach Organ und Art haben sie ganz verschiedene Eigenschaften: einige vermehren sich schnell, andere langsam; einige gelangen in andere Organe und bilden dort Metastasen, andere so gut wie nie; einige lassen sich beeinflussen, andere nicht.
Dies alles gilt es vor einer Behandlung herauszufinden. Dazu werden neben der radiologischen Diagnostik fast immer Gewebeproben entnommen und in Speziallabors untersucht.
Liegen alle Untersuchungsergebnisse vor, wird ein individueller Behandlungsplan ausgearbeitet, der auf die spezielle Art und Ausbreitung der Tumorerkrankung zugeschnitten ist. Auch die Beschwerden werden berücksichtigt, die eine Geschwulst macht, wenn sie z.B. einen Nerv einklemmt oder die Lymphbahnen verlegt, sowie die Lebenssituation und das Alter der Patientin/des Patienten. Zum Beispiel behandelt man Brustkrebs vor den Wechseljahren der Frau anders als danach.
Das eine in allen Fällen wirksame Krebsmedikament und die einzigartig helfende Krebstherapie kann es nicht geben. Im Gegenteil, die Behandlungsmöglichkeiten werden immer vielfältiger und immer individueller. Wichtig ist es, ein Team von Ärzten zu finden, das über viel Erfahrung mit all den wirksamsten Behandlungsmethoden verfügt und diese nach internationalen Standards miteinander kombiniert. Diese Kompetenz finden Sie in unserer Abteilung für Hämatoonkologie und in unserer Klinik.
Die Krebsbehandlung mit Medikamenten (Chemo-, Hormon- und Immuntherapie) kann man sich als eine Art Reinigung des Körpers von wachstumsgestörten Zellen vorstellen. Die Wirkung der Medikamente beruht darauf, dass das unkontrollierte Wachstum der Tumorzellen gestoppt wird. Sogenannte Zytostatika (Hemmstoffe der Zellteilung) wirken auf den Stoffwechsel der Tumorzelle ein, damit sie ihre Wachstumsfähigkeit verliert und abstirbt.
Zur medikamentösen Krebstherapie gehört auch die Behandlung mit Hormonen (Wirkstoffe innerer Drüsen) oder die Immuntherapie, die mit Hilfe körpereigener Botenstoffe (z.B. Interferone, Interleukine) bzw. mit spezifischen Antikörpern (z.B. Trastuzumab, Rituximab, Bevacizumab, Bortezomib u.v.a.) direkt in die Zellregulation eingreift und das Tumorwachstum behindert. Eine besondere Art der Immuntherapie sind die sogenannten Checkpoint-Inhibitoren (z.B. Ipilimumab, Nivolumab, Atezolizumab u.a.). Sie heben die Blockade einer körpereigenen Immunantwort auf, um damit die Tumorzelle wieder dem Angriff durch immunkompetente Zellen zugänglich zu machen. Das Problem ist, dass sich die entkoppelte Immunreaktion auch auf gesundes Gewebe schädlich auswirken kann.
Die aktuelle medizinisch Forschung beschäftigt sich besonders mit den molekularen Grundlagen der Krebsentstehung. Durch ein umfassendes molekulares Tumorprofiling können Patienten identifiziert werden, bei denen potentiell therapierbare Genmutationen in den Tumorzellen (bzw. Leukämiezellen) nachweisbar sind und bei denen damit eine zielgerichtete Krebstherapie einen gewissen Behandlungserfolg erwarten lassen.
Leider gibt es keine wirksamen Krebstherapien ohne Risiken und Nebenwirkungen, auch wenn andere das oft versprechen. Wir bemühen uns, die Nebenwirkungen so gering wie möglich zu halten oder durch zusätzliche Medikamente auszuschalten.
Umgang mit Nebenwirkungen und Krankheitsfolgen (Quelle: www.krebsinformationsdienst.de © 2018 Krebsinformations-dienst, Deutsches Krebsforschungszentrum)
„Alternative Krebstherapie“
Die Entscheidung zu einer möglicherweise belastenden Chemo-/Immuntherapie fällt schwer. Da liegt es nahe zu fragen, ob es nicht einfachere Alternativen gibt. In der Laienpresse und auch anderswo werden viele Behandlungsformen angepriesen, von denen behauptet wird, dass sie Krebserkrankungen heilen können und das auf natürliche, sanfte Weise. Von speziellen Diäten, von Kräuter- Behandlungen ist da die Rede, pseudotechnische Verfahren wie Sauerstoff- Krebs-Mehrschritt-Therapie werden empfohlen oder auch indische und chinesische Medizin. Wissenschaftlich verwertbare und nachvollziehbare nützliche Ergebnisse konnte allerdings keines dieser Verfahren bis heute belegen.
Die Motive, die hinter solchen Empfehlungen stehen, sind nicht immer lauter. Nicht selten wird sogar die Notlage von Krebspatienten ausgenutzt, um dubiose Geschäfte zu machen. Seien Sie bei als Wundermittel angepriesenen Medikamenten oder Verfahren skeptisch und fragen Sie uns bzw. Ihren behandelnden Arzt dazu. Auf keinen Fall sollten Sie eine erkennbar erfolgreiche Chemo-/Immuntherapie zugunsten solcher Methoden abbrechen!
Eine ausführlich Information über alternative und komplementäre Krebsmedizin erhalten Sie beim Krebsinformationsdienst (KID): hier….
Die Anwendung der medikamentösen Krebstherapie erfolgt in der Regel mittels intravenöser Injektionen oder Infusionen (Spritze und/oder Dauertropf in die Vene). Die Venen am Arm sind für die Infusion oft risikoreich oder gar nicht geeignet, so dass ein „zentralvenöser Zugang“ gebraucht wird. Dafür wird entweder ein sogenannter „Jugularis-Katheter“ oder ein verdeckt im Körper implantiertes PORT-System verwendet. Das PORT-System verbleibt während der gesamten Therapiezeit (ggf. über Monate und Jahre) im Körper, ist immer problemlos erreichbar, erleichtert erheblich die Anwedung von intravenösen Infusionen und Transfusionen, reduziert das Risiko einer Venen-Entzündung und ist Voraussetzung für den Einsatz von tragbaren Infusionspumpen.
Wie läuft eine Chemo-/Immuntherapie ab?
Wie kann man sich den Ablauf einer Chemo-/Immuntherapie praktisch vorstellen? Nachdem der Patient vollständig untersucht wurde, um das genaue Ausmaß der Krebserkrankung festzustellen und nachdem auch alle wichtigen anderen nicht an der Erkrankung beteiligten Organe auf ihre Funktion überprüft wurden, wird ein individueller Behandlungsplan erstellt. In diesem Behandlungsplan werden meist mehrere Krebsmedikamente kombiniert und so dosiert, dass die Wirkung auf den Tumor verstärkt wird und die unerwünschten Begleiterscheinungen vermindert werden. Die Zusammensetzung dieser Medikamente besteht aus Tabletten (orale Medikamente) und/oder Spritzen und/oder Infusionen (i.v.-Therapie). Infusionen werden über eine Armvene oder über ein PORT-System dem Körper zugeführt. Diese Infusion läuft meist 2-4 Stunden. Der Patient sitzt dabei in einem bequemen Sessel oder liegt in seinem Bett. Ambulante Patienten können nach der Infusion nach Hause gehen und müssen dann zu einem vereinbarten Termin am nächsten Tag oder nach 2 – 3 Wochen wiederkommen. Es werden in der Regel mehrere Behandlungszyklen gegeben, um eine optimale Wirkung gegen den Krebs zu erreichen. D.h. eine medikamentöse Krebsbehandlung zieht sich in der Regel über einige Monate hin.
Wissenschaft/Fortschritte und Studien
Medikamente gegen Krebs
Krebsheilmittel sind schon im Altertum gebraucht worden z.B. das in einem Papyrus ca. 1.500 Jahre vor Chr. erwähnte Arsen. Damit ist die medikamentöse Bekämpfung des Krebses viel älter als die chirugische Behandlung oder die verhältnismäßig junge Strahlentherapie. Einen richtigen Durchbruch hat die internistische Tumorbehandlung allerdings erst vor ca. 70 Jahren erfahren. Im Jahr 1946 konnte der Beweis angetreten werden, daß mit Nitrogen-Mustard bösartige Tumoren des Menschen zur Rückbildung gebracht werden können. Es wurden in den folgenden Jahren und Jahrzehnten eine Vielzahl neuer Medikamente entwickelt, die die Krebszellen am Wachstum hindern. Aus der Zeit der 60 iger Jahre, in der man allgemein sehr viel von moderner Chemie hielt, stammt auch der Begriff der Chemotherapie, obwohl diese Behandlung keineswegs einer einfachen chemischen Reaktion, oder gar einer „chemischen Reinigung“ entspricht.
Wirkung von Krebsmedikamenten
Die Wirksamkeit einer medikamentöse Krebstherapie beruht auf komplexen und komplizierten biologischen Vorgängen, von denen in den letzten 50 Jahren immer mehr wissenschaftlich aufgeklärt worden sind. Entsprechend dieser biologischen Grundlage müsste die Chemotherapie eigentlich „biowissenschaftliche Therapie“ genannt werden. Sie ist eine biologische Behandlung, die auf naturwissenschaftlichen Erkenntnissen basiert. Das Wissen über die Stoffwechselvorgänge und Wachstumsregulationsmechanismen in den Zellen und insbesondere die Kenntnis über die besonderen Abläufe in den Krebszellen erlaubt zunächst im Laborexperiment die Entwicklung von biologischen Faktoren, die in diese Zellregulation eingreifen können. Ist eine solche Substanz gefunden, die die Krebszelle am Wachstum hindern und abtöten kann, bzw. die Apoptose (programmierte Selbstauflösung der Tumorzelle) einleitet, folgt ein langer Weg der Prüfung und Forschung, um diese Entdeckung schließlich als Krebsbekämpfungsmedikament am Menschen einsetzen zu können. Bei dieser Prüfung müssen Erfahrungen gesammelt werden, die für eine zuverlässige und sichere Anwendung der Krebsmedikamente erforderlich sind.
Die Krebstherapie nutzt bei unterschiedlichen Tumorerkrankungen sehr verschiedene Wege und Ansatzpunkte. Allerdings sind auch die Erfolge sehr unterschiedlich. So können Patienten mit Lymphknotenkrebs vom Typ der Hodgkinschen Erkrankung oder junge Männer mit Hodenkrebs auch in fortgeschrittenen Stadien in ungefähr 90 % der Fälle mit einer Chemotherapie geheilt werden. Bei einigen anderen Krebserkrankungen hat die medikamentöse Therapie nicht so große Erfolge, ist aber dennoch im Sinne einer Verminderung des Tumorwachstums wirksam. Meist wird eine genau abgestimmte Folge verschiedener Therapieformen, nämlich Operation, Chemotherapie, Hormontherapie, Immun-/Antikörpertherapie und Bestrahlung oder Teile davon benötigt, um den Tumor vollständig zu beseitigen.
Chemo-/Immuntherapie – Wirkung im Körper
Das dem Körper über eine Vene (als Spritze oder Infusion) oder über den Magen (als Tablette) zugeführte Krebsmedikament ist quasi ein falscher Baustein. D.h. das Medikament sieht für die Krebszelle so aus wie ein Baustein zum Wachsen (z.B. ein Vitamin oder eine Aminosäure) und wird deswegen von der Zelle aufgenommen. Da das Medikament aber als Baustein nicht funktioniert, hängt die Zelle in ihrem Teilungsprozeß fest, sie ist arretiert und kann sich nicht mehr weiterentwickeln und geht so zu grunde und stirbt ab (Fachbegriff: Apoptose). Die meisten Chemotherapeutika (wie z.B. Cyclophosphamid, Adriamycin, Fluorouracil, Vincristin, Methotrexat, Pemetrexed, Platin, Taxane und andere) wirken auf diese Weise. Andere Antikrebsmittel setzen an Signalstrukturen der Zelldifferenzierung und der Wachstumsregulation an. Dies wird erreicht durch spezifische Antikörper (z.B. Rituximab, Trastuzumab, Cetuximab, Bevacizumab, Ramicirumab u.a.) oder bestimmte Signalhemmstoffe (Imatinib, Erlotinib, Afatinib, Sorafinib, Sunitinib, Temsirolimus, Bortezomib, BRAF- und MEK-Inhibitoren u.a.). Man nennt diese Behandlungen auch Immun- oder Target-Therapie.
Die neueste Entwicklung der Therapiemöglichkeiten betrifft die Deblockade der körpereigenen Immunabwehr durch T-Zellen (sogen. Immun-Checkpoint-Inhibitoren) und die auf Genmutationen gerichtete personalisierte Therapie. Die aktuellen Erkenntnisse der Grundlagenforschung (Biomolekulare Forschung) haben zu einem sensationellen Innovationsschub bei der systemischen Tumortherapie geführt. Erstmals wurden bei sehr seltenen Tumorerkrankungen molekulare Veränderungen festgestellt, die unabhängig von der Lokalisation und Histologie des Tumors Behandlungsoptionen eröffnen können. Die Hoffnungen sind hoch, die Erfahrungen aus entsprechenden Studien noch gering.
Nach aktuellem Wissensstand wird aus diesen Medikamenten oft eine Kombination bzw. eine Behandlungssequenz gewählt, die die unterschiedlichen Wirkprinzipien auf die biologischen Eigenschaften des Tumors für den größtmöglichen Therapieerfolg ausnutzt.
Studien
Um Fakten zu sammeln über die Wirksamkeit einer Krebsbehandlung am Menschen, benötigt man aber große Studien, die weltweit an vielen hunderten und tausenden von Patienten durchgeführt werden. Trotz sehr detaillierter Kenntnisse über die Eigenschaften und Wachstumsmechanismen von Tumorzellen bleiben immer noch viele unbekannte Faktoren, die wir bis heute nicht kennen. Weil es immer noch so viele unbekannte Größen gibt, die die Behandlung von Tumoren beeinflussen, hat die Onkologie als eine der ersten Disziplinen in der Medizin die systematischen klinischen Studien eingeführt. Diese wissenschaftliche Untersuchungsform ist eigentlich nichts anderes als eine besonders sorgfältige und genaue Erfahrungsmedizin. Ein Behandlungskonzept wird als Hypothese formuliert und dann durch eine Studie an vielen hundert Patienten bestätigt oder verworfen. Die Teilnahme an einer Studie bietet dem Patienten besondere Vorteile:
- Bei den ersten zu sein, die von der möglicherweise besseren Therapie profitieren
- Intensivere Betreuung mit regelmäßigen Untersuchungen und gewissenhafter Dokumentation
- Bessere Qualitätskontrolle, weil alle Patientinnen nach strengen, von externen Gutachtern überwachten Richtlinien behandelt werden.
Klinische Studien, was verbirgt sich dahinter? (eine Information der Unabhängigen Patienten Beratung Deutschland)
Beispiel Studie
Was heißt das nun praktisch? Nehmen wir mal das Beispiel des Brustkrebses:
Man hat schon vor ca. 50 Jahren die Erfahrung gemacht, dass Patientinnen mit Brustkrebs, die nach der Operation eine Chemotherapie erhalten haben, später seltener Metastasen oder Rezidive erleiden. Vergleicht man nun zwei gleiche Gruppen von Patienten, von denen eine Gruppe mit einer sogenannten adjuvanten Chemotherapie behandelt wird und die andere Gruppe nicht, so stellt man als Faktum fest, dass in der nicht behandelten Gruppe 40 % der Patienten innerhalb von 5 – 10 Jahren wieder Krebs bekommen, in der behandelten Gruppe aber nur 25 %. Diese Erkenntnis war damals revolutionär und wurde nun im Laufe der Jahre durch weitere wissenschaftliche Studien vertieft und ergänzt.
Prognostische Faktoren
Wir kennen heute eine Reihe prognostischer Faktoren, wie z.B. die Größe des Primärtumors, die Zahl der befallenen Achsellymphknoten, der Hormonrezeptorstatus, die Präsentation eines Onkogens (z.B. HER2) u.a., aus denen wir ablesen können, wie hoch z.B. das Risiko ist, dass die Krankheit nach erfolgreicher Operation wieder auftritt. An Hand dieser Faktoren können wir die notwendige Therapie in ihrer Intensität individuell auf den Patienten abstimmen. Es gibt weitere Faktoren, die möglicherweise auch von prognostischer Bedeutung sind, wie z.B. genetische Marker, Chromosomenveränderungen in der Tumorzelle oder Produkte aus Tumoren, die im Blut gemessen werden können, oder andere Zelldifferenzierungsmarker. Auch das Aufspüren einzelner schlafender Krebszellen im Knochnmark kann ein prognostischer Faktor sein. Diese Faktoren befinden sich z.Zt. bereits in der klinischen Prüfung und wir erwarten davon in Zukunft noch eine weitere Verfeinerung der Behandlungsstrategien. Bei den Leukämien haben diese Faktoren bereits heute einen entscheidenden Einfluss auf die Behandlungsoptionen.
Verträglichkeit der Chemo-/Immuntherapie
Mit einer Verbesserung und Verfeinerung der Behandlungsstrategien ist neben einer Verbesserung der Tumorvernichtung auch eine Optimierung der Verträglichkeit und Verringerung der Nebenwirkungen verbunden. Gerade auch auf diesem Feld der Minimierung der unerwünschten Nebenwirkungen hat man in den letzten Jahren deutliche Fortschritte erzielt. So konnten für eine Reihe von Tumoren wirksame Krebsbehandlungen entwickelt werden, bei denen z.B. das Problem des Haarausfalls praktisch keine Rolle spielt. Dennoch kommen wir auch heute bei einigen Krebs- und Leukämieerkrankungen nicht ohne die Medikamente aus, die auch mit Haarausfall verbunden sein können. Dazu gehören z. B. auch die ganz modernen sehr wirksamen pflanzlichen Antikrebsmittel vom Typ der Taxane (aus der Rinde bzw. den Blättern der Eibe).
Die in den letzten Jahren entwickelten Immuntherapien (besonders die sogen. Checkpoint-Inhibitoren) weisen im Vergleich zur klassischen Chemotherapie gänzlich andere unerwünschte Begleiterscheinungen auf, die vor allem durch übermäßige Immunreaktionen an gesunden Organstrukturen hervorgerufen werden. Zur rechtzeitigen Erkennung und Behandlung dieser oft überraschenden und untypischen Krankheitssymptome ist viel Erfahrung und eine besondere Aufmerksamkeit des behandelnden Onkologen und auch eine intensive Überwachung und Mitwirkung des Patienten erforderlich.
Medikamente zur Verhinderung von Nebenwirkungen
Zur Vermeidung von Nebenwirkungen stehen uns heute sehr wirkungsvolle Medikamente zur Verfügung. Die Verhinderung der Übelkeit und des zytostatikabedingten Erbrechens ist z.B. mit Zofran, Kevatril, Emend, Dexamethason u.a. Medikamenten möglich. Mit sogenannten Wachstumsfaktoren kann bei Hochdosistherapie eine rasche Regeneration der Blutbildung angeregt werden, um Infektionen zu verhindern. Viele Medikamente aus dem Bereich der pflanzlichen Wirkstoffe wie Kamille, Salbei, Myrrhe, Fenchel, Echinacin, Pectine, Lectine usw. haben einen festen Platz in der Begleitbehandlung von Tumorerkrankungen. Um unerwünschte Nebenwirkungen erst gar nicht auftreten zu lassen, werden diese Medikamente prophylaktisch bereits von Anfang an eingesetzt.
Teamwork
So wie das Zusammenwirken der verschiedenen Medikamente zu einer erfolgreichen Therapie wird, so ist in der ambulanten und stationären Tumortherapie auch die Zusammenarbeit und das Teamwork der beteiligten medizinischen Personen von entscheidender Bedeutung. Dazu gehören die Krankenschwester, der Facharzt, die Psychologin, die Lymphtherapeutin und die Krankengymnastin, die Ernährungsberatung, der Schmerztherapeut und vor allem der Hausarzt, der alles in einem für den Patienten optimalen Rahmen koordinieren muss.
Indikationen
Die Erfolge und die Wirksamkeit der Chemo-, Immun- oder Hormontherapie stützt sich auf klare wissenschaftliche Fakten. Wir können mit diesen Therapien bei einigen Krebsarten das Rezidiv (das Wiederauftreten) verhindern, wir können einige Krebsarten heilen, bei anderen Arten das Wachstum stoppen und verzögern oder die schädigenden und schmerzenden Einflüsse des Krebses bekämpfen. Es gibt leider auch eine Reihe von Tumorstadien, bei denen diese Therapien nicht wirksam sind. Jedoch gibt es auch hierfür helfende Behandlungsstrategien, die die individuelle Besonderheiten der Tumorerkrankung und des Patienten berücksichtigen. Dies ist vor allem auch das weite Feld der Palliativmedizin. Ein „Aufgeben“, ein „die Flinte ins Korn werfen“ oder ein „wir können nichts mehr tun“ kennen wir nicht. Dennoch ist es oft schwierig, das Richtige zum richtigen Zeitpunkt zu tun. Mit Augenmaß, viel Erfahrung und Empathie sowie mit Vertrauen gelingt es auch bei schwierigen Krankheitsverläufen für ein realistisches Ziel einen hoffnungsvollen Weg zu finden.
Einsatz eines Portsystems
Warum hat Ihnen Ihr Arzt einen „PORT“ empfohlen?
Ihre Behandlung erfordert die häufige oder ständige Verabreichung von Arzneimitteln oder anderen Flüssigkeiten in den venösen Blutkreislauf.
Die Arznei könnte auch über eine Armvene injiziert werden. Das wiederholte Anstechen der Venen ist jedoch schmerzhaft und bestimmte Zytostatika schaden den Gefäßen. Zudem sind insbesondere schlechte Venenverhältnisse oder das Unvermögen, überhaupt noch venöse Zugänge zu finden, Anlass einen Port anzulegen.
Was ist ein „Port“?
„Port“ ist die allgemein gebräuchliche Abkürzung für ein voll implantiertes Port-Katheter-System, auch Port-a-cath genannt.
Ein Portsystem besteht aus zwei Teilen, dem Port und dem Katheter:
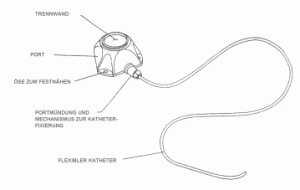
Skizze Portsystem
- Der Port ist eine kleine Kammer, meist aus Kunststoff, ca. 30 mm Durchmesser. Das Portgehäuse sieht wie ein abgeschnittener Kegel aus und ist mit einer Scheibe aus Silikon (Membran) verschlossen.
- An der Basis des Ports ist ein flexibler Schlauch, „Katheter“, angeschlossen. Der Katheter wird in ein großes Blutgefäß eingeführt und befördert die in den Port verabreichten Medikamente direkt in den Blutstrom.

Portquerschnitt
Wie und wo wird das Portsystem eingesetzt (implantiert)?
Das Portsystem wird im Krankenhaus (z.B. Stade oder Buxtehude) während einer kurzen Operation bei örtlicher Betäubung oder auch ggf. bei kurzer Vollnarkose eingesetzt. Sie können Ihr Portsystem in einer ambulanten Operation einsetzen lassen und anschließend nach Hause gehen.
Meist wird das System im Bereich des Brustkorbs direkt unter dem Schlüsselbein platziert. Für die Implantation eines Ports genügt in den meisten Fällen ein kleiner Schnitt. Der Katheter wird in die ausgewählte Vene eingelegt. Unter der Haut wird eine Tasche gebildet, um den Port aufzunehmen. Der Katheter wird an den Port angeschlossen und das Portgehäuse wird in der Hauttasche sicher angenäht. Eine kleine Naht ist erforderlich, um die Hauttasche wieder zu verschließen, wenn der Port an seinem Platz liegt. Zum Schutz der Wunde wird ein kleiner Verband angelegt.

Portquerschnitt mit Nadel
Nach der Implantation sehen Sie nur noch eine kleine Erhebung unter der Haut, die mit den Fingern leicht zu ertasten ist.
Die Umgebung ist noch für einige Tage geschwollen und empfindlich. Diese Reizung verschwindet, wenn die Operationswunde verheilt. Der Port kann, wenn nötig, sofort benutzt werden. Während der ersten Tage nach der Operation sollten Sie größere Anstrengungen vermeiden.
Vor der ersten Infusion über den Port nach der Implantation bekommen Sie bei uns ein kleines Betäubungspflaster, das sog. „Emla-Pflaster“, damit der Einstich gut toleriert wird.
Wann wird der „Port“ benutzt?
Ein Portsystem dient meist als venöser Zugang. Das Wort „venös“ weist auf Blutgefäße hin, die das Blut zum Herzen transportieren. „Zugang“ meint in diesem Zusammenhang einen Weg, der in das Blutgefäß hineinführt.
Der Port kann also sowohl zur Entnahme von Blut als auch zur Verabreichung von Medikamenten genutzt werden. Bei Infusionen bleibt die Nadel an Ort und Stelle in der Portkammer und wird mit einem sterilen Verband abgedeckt. Bei Mehrtagestherapie kann die Nadel ca. 7 Tage liegen bleiben.

Portnadel mit speziellem Schliff
Zum Anstechen (punktieren) des PORT’s dürfen nur speziell geschliffene, nicht stanzende Kanülen (z.B. Gripper-Nadeln, Huber-Nadeln) verwendet werden. Nur so ist sichergestellt, dass sich nach dem Entfernen der Nadel die Silikonmembran wieder sicher verschließt und keine Medikamente in das Gewebe austreten.
Um den PORT über lange Zeit gebrauchsfähig zu erhalten, muss nach jeder Behandlung der PORT sorgfältig gespült werden. Die Spülung erfolgt mit 10 ml Kochsalzlösung (NaCl 0,9%). Weitere Zusätze sind nicht erforderlich. Achten Sie bitte selbst auf diese Handhabung, sollte außerhalb unseres Hauses der PORT benutzt werden, bzw. eine angeschlossene Medikamentenpumpe abgenommen werden!
Was sollte ich als Patient mit einem Port beachten?
Mit einem PORT können Sie sich schon wenige Tage nach der Implantation vollkommen normal und frei bewegen. Mit dem implantierten PORT können Sie
- baden
- schwimmen und
- Sport treiben.
Nach Beendigung der Behandlung bleibt der PORT in der Regel noch ein bis zwei Jahre liegen, bevor er wieder explantiert wird.
Für weitere Fragen wenden Sie sich bitte an das Onkologie-Team:
Frau Block, Frau Gross, Frau Peters, Frau Tyranowski, Frau Koch oder Frau Ertlmaier
oder Ihre behandelnden Ärzte
Das Team des MVZ Hämatologie-Onkologie Klinik Dr. Hancken
Das Team des Hämatologischen und Onkologischen Schwerpunktes
mit Palliativmedizin
im MVZ Klinik Dr. Hancken
Ärzte / Ärztinnen

Dr. med. Sabine Matutat
Fachärztin für Innere Medizin,
Hämatologie und Onkologie
Leitende Ärztin der Onkologie

Dr. med. Wiebke Timm
Fachärztin für Innere Medizin,
Hämatologie und Onkologie
Leitende Ärztin der Onkologie

Dr. med. Kathrin Engelken
Fachärztin für Gynäkologie und Geburtshilfe,
Zusatzbezeichnung: Palliativmedizin und
medikamentöse Tumortherapie
Genetische Beratung – fachgebunden
Leiterin des Brustzentrums Stade-Buxtehude

Prof. Dr. med. Stefan Frühauf
Facharzt für Innere Medizin
Hämatologie und Onkologie
Palliativmedizin Ernährungsmedizin
Chefarzt Hämatologie, Onkologie und Palliativmedizin
Leitender Arzt Spezielle ambulante Palliativversorgung

Dr. med. Kim Ahlf
Facharzt für Innere Medizin, Gastroenterologie,
Hämatologie, Onkologie und Palliativmedizin

Dr. med. Britta Heitmann
Fachärztin für Innere Medizin,
Hämatologie und Onkologie
Praxisteam – Organisation – Termine
Frau Nicole Burschik
Frau Nadine Geschwandtner
Frau Heidi Herbst
Frau Janne Lobitz
Frau Kerstin Niemeyer
Frau Nina Oldenburg
Frau Tanja von Raedern
Frau Silke Willenbockel
Therapie – Infusionen (Tagesklinik)
Frau Ulrike Block
Frau Beeke Junge
Frau Gülay Karabulut
Frau Christina Koschel
Frau Sara Peters
Frau Janine Pfläging
Frau Kristin Scheithauer
Frau Ronja Tiedemann
Frau Elisabeth Tyranowski
Frau Olga Wulfert
Frau Susanne Hune
Labor
Frau Natascha Heinrichs
Frau Sabine Blunck
Frau Brigitte Kluge
Studienzentrale / Studiendokumentation
Frau Birte Rahn
Frau Karen Kirchhoff
Dokumentation – Nachsorge
Frau Silke Borm
Frau Petra Lipka
Frau Karin Schönbeck-Hering
Frau Mandy Zühlsdorf
Die Ärzte gehören der Ärztekammer Niedersachsen an. Die vollständige Berufsbezeichnung ist zu dem jeweiligen Arzt angegeben. Die Berufsbezeichnung wurde von allen hier verzeichneten Ärzten in der Bundesrepublik Deutschland erworben. Die niedersächsische Berufsordnung für Ärzte kann bei der Ärztekammer Niedersachsen, Berliner Allee 20, 30175 Hannover (http://www.aekn.de/) angefordert werden.
Podcast Interview im Stader Tageblatt
Informationen zu Diagnostik und Behandlung von Brustkrebs in der Klinik Dr. Hancken bieten zwei Podcasts „Medizin hautnah“ des Tageblatts.
Die Sicht einer Patientin auf Erkrankung und Behandlung präsentiert der jüngste Podcast von Tageblatt-Chefredakteur Wolfgang Stephan mit Frau Anja Laskowski und ihrer behandelnden Ärztin Dr. Kathrin Engelken.
Die Podcasts finden Sie hier:*
Medizin hautnah Nr. 12 mit Anja Laskowski und Dr. Engelken
*Weiterleitung zu einer externen Seite (Spotify)